Bagaimana komposisi unsur pembentuk senyawa? Perhatikan data percobaan pada Tabel 2, reaksi antara oksigen dan hidrogen menjadi air:
Tabel 2. Data percobaan reaksi antara oksigen dan hidrogen menjadi air
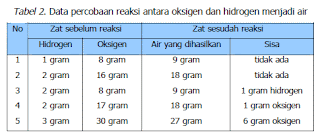
1. Hitunglah perbandingan massa hidrogen dan oksigen dalam senyawa air pada percobaan 1,2,3,4, dan 5. Bagaimana hasilnya?
2. Apa yang terjadi jika massa hidrogen dan oksigen yang direaksikan tidak sesuai dengan perbandingan tersebut?
3. Apa kesimpulan anda tentang perbandingan unsur dalam suatu senyawa?
Air tersusun dari hidrogen dan oksigen. Dari perhitungan yang telah anda lakukan ternyata perbandingan massa hidrogen dan oksigen dalam senyawa air adalah tetap, yaitu 1: 8. Jika massa hidrogen dan oksigen yang direaksikan tidak sesuai dengan perbandingan tersebut maka akan terdapat sisa salah satu unsur. Jadi perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap. Pernyataan ini dikenal dengan hukum perbadingan tetap.
Rumus Kimia
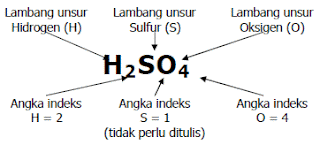
Suatu atom tunggal dapat dilambangkan dengan lambang unsur. Kecenderungan atom-atom untuk membentuk molekul atau ion menyebabkan perlunya suatu notasi yang disebut rumus kimia. Rumus kimia suatu zat memuat informasi tentang jenis unsur dan jumlah atau perbandingan atom-atom unsur penyusun zat.
Secara umum, rumus kimia dinyatakan dengan lambang unsur dan angka indeks. Lambang unsur menunjukkan jenis unsur sedangkan angka indeks menunjukkan jumlah atau perbandingan atom-atom unsur. Angka indeks ditulis sebagai subskrip setelah lambang unsur. Rumus kimia dibedakan menjadi rumus molekul dan rumus empiris.
Rumus molekul
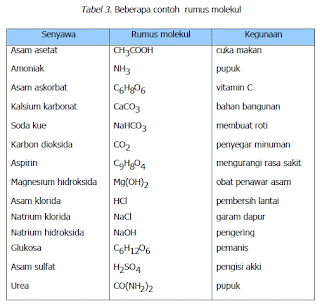
Kolom kedua pada Tabel 3, adalah rumus molekul. Rumus molekul merupakan gabungan lambang unsur yang menunjukkan jenis unsur pembentuk senyawa dan jumlah atom masing-masing unsur. Misalnya, sukrosa mempunyai rumus C12H22O11. Rumus tersebut menunjukkan bahwa sukrosa tersusun dari karbon, hidrogen, dan oksigen. Rumus tersebut juga menunjukkan bahwa satu molekul gula tersusun dari 12 atom karbon, 22 atom hidrogen dan 11 atom oksigen.
Vitamin C tersusun dari unsur C, H, O seperti penyusun gula, tetapi jumlah atom penyusunnya berbeda. Vitamin C mempunyai rumus C6H8O6, setiap satu molekul vitamin C mengandung 6 atom karbon, 8 atom hidrogen, dan 6 atom oksigen. Meskipun gula dan vitamin C tersusun dari jenis unsur yang sama tetapi mempunyai sifat yang berbeda, hal ini disebabkan karena jumlah masing-masing unsur dalam senyawa tersebut berbeda.
Urea merupakan pupuk yang telah lama digunakan. Urea mempunyai rumus senyawa CO(NH2)2. Dari rumus senyawa tersebut dapat ditunjukkan bahwa urea tersusun dari unsur karbon (C), oksigen (O), nitrogen (N) dan hidrogen (H). Dalam satu molekul urea terdapat 1 atom karbon, 1 atom oksigen, 2 atom nitrogen dan 4 atom hidrogen.
Tabel 3. Beberapa contoh rumus molekul
Rumus empiris
Rumus empiris adalah rumus kimia yang menyatakan perbandingan atom-atom yang paling kecil (sederhana). Glukosa mempunyai rumus molekul C6H12O6 dengan perbandingan C: H: O = 6: 12: 6. Perbandingan ini dapat disederhanakan menjadi C: H: O = 3: 6: 3. Perbandingan tersebut masih dapat disederhanakan lagi menjadi C: H: O = 1: 2: 1. Perbandingan ini merupakan perbandingan yang paling kecil, sehingga rumus empiris dari glukosa adalah CH2O.
Jika suatu senyawa mempunyai rumus molekul dengan perbandingan atom-atom yang tidak dapat disederhanakan lagi, maka rumus empiris sama dengan rumus molekulnya. Contohnya air H2O, karbon dioksida CO2, asam sulfat H2SO4. Tabel 4 menunjukkan beberapa contoh rumus empiris.

Tabel 2. Data percobaan reaksi antara oksigen dan hidrogen menjadi air

1. Hitunglah perbandingan massa hidrogen dan oksigen dalam senyawa air pada percobaan 1,2,3,4, dan 5. Bagaimana hasilnya?
2. Apa yang terjadi jika massa hidrogen dan oksigen yang direaksikan tidak sesuai dengan perbandingan tersebut?
3. Apa kesimpulan anda tentang perbandingan unsur dalam suatu senyawa?
Air tersusun dari hidrogen dan oksigen. Dari perhitungan yang telah anda lakukan ternyata perbandingan massa hidrogen dan oksigen dalam senyawa air adalah tetap, yaitu 1: 8. Jika massa hidrogen dan oksigen yang direaksikan tidak sesuai dengan perbandingan tersebut maka akan terdapat sisa salah satu unsur. Jadi perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap. Pernyataan ini dikenal dengan hukum perbadingan tetap.
Rumus Kimia
Suatu atom tunggal dapat dilambangkan dengan lambang unsur. Kecenderungan atom-atom untuk membentuk molekul atau ion menyebabkan perlunya suatu notasi yang disebut rumus kimia. Rumus kimia suatu zat memuat informasi tentang jenis unsur dan jumlah atau perbandingan atom-atom unsur penyusun zat.
Secara umum, rumus kimia dinyatakan dengan lambang unsur dan angka indeks. Lambang unsur menunjukkan jenis unsur sedangkan angka indeks menunjukkan jumlah atau perbandingan atom-atom unsur. Angka indeks ditulis sebagai subskrip setelah lambang unsur. Rumus kimia dibedakan menjadi rumus molekul dan rumus empiris.

Rumus molekul
Kolom kedua pada Tabel 3, adalah rumus molekul. Rumus molekul merupakan gabungan lambang unsur yang menunjukkan jenis unsur pembentuk senyawa dan jumlah atom masing-masing unsur. Misalnya, sukrosa mempunyai rumus C12H22O11. Rumus tersebut menunjukkan bahwa sukrosa tersusun dari karbon, hidrogen, dan oksigen. Rumus tersebut juga menunjukkan bahwa satu molekul gula tersusun dari 12 atom karbon, 22 atom hidrogen dan 11 atom oksigen.
Vitamin C tersusun dari unsur C, H, O seperti penyusun gula, tetapi jumlah atom penyusunnya berbeda. Vitamin C mempunyai rumus C6H8O6, setiap satu molekul vitamin C mengandung 6 atom karbon, 8 atom hidrogen, dan 6 atom oksigen. Meskipun gula dan vitamin C tersusun dari jenis unsur yang sama tetapi mempunyai sifat yang berbeda, hal ini disebabkan karena jumlah masing-masing unsur dalam senyawa tersebut berbeda.
Urea merupakan pupuk yang telah lama digunakan. Urea mempunyai rumus senyawa CO(NH2)2. Dari rumus senyawa tersebut dapat ditunjukkan bahwa urea tersusun dari unsur karbon (C), oksigen (O), nitrogen (N) dan hidrogen (H). Dalam satu molekul urea terdapat 1 atom karbon, 1 atom oksigen, 2 atom nitrogen dan 4 atom hidrogen.
Tabel 3. Beberapa contoh rumus molekul

Rumus empiris
Rumus empiris adalah rumus kimia yang menyatakan perbandingan atom-atom yang paling kecil (sederhana). Glukosa mempunyai rumus molekul C6H12O6 dengan perbandingan C: H: O = 6: 12: 6. Perbandingan ini dapat disederhanakan menjadi C: H: O = 3: 6: 3. Perbandingan tersebut masih dapat disederhanakan lagi menjadi C: H: O = 1: 2: 1. Perbandingan ini merupakan perbandingan yang paling kecil, sehingga rumus empiris dari glukosa adalah CH2O.
Jika suatu senyawa mempunyai rumus molekul dengan perbandingan atom-atom yang tidak dapat disederhanakan lagi, maka rumus empiris sama dengan rumus molekulnya. Contohnya air H2O, karbon dioksida CO2, asam sulfat H2SO4. Tabel 4 menunjukkan beberapa contoh rumus empiris.






0 comments:
Posting Komentar