Zat-zat lain di sekitar kita berupa molekul-molekul gas, cair, dan ada beberapa zat berupa padatan tersusun atas atom-atom yang menggunakan ikatan kovalen. Atom-atom yang sama atau hampir sama keelektronegatifannya cenderung membentuk ikatan kovalen dengan menggunakan pasangan elektron bersama.
Hampir semua senyawa kovalen terbentuk dari atom-atom non-logam. Dua atom nonlogam saling menyumbangkan elektron sehingga tersedia satu atau lebih pasangan elektron yang dijadikan milik bersama. Senyawa yang berikatan kovalen juga disebut senyawa kovalen.
Atom hidrogen memiliki sebuah elektron pada kulit pertamanya, agar konfigurasi elektronnya penuh seperti gas mulia helium maka hidrogen memerlukan satu elektron lagi (gambar 1). Gas hidrogen yang merupakan molekul H2 terdiri dari dua atom hidrogen yang saling menyumbangkan elektronnya sehingga masing-masing atom hidrogen memiliki konfigurasi elektron yang stabil.
Jika kita perhatikan gambar 1, elektron pada atom pertama diberi tanda titik kecil dan atom lainnya dengan titik besar. Pasangan elektron yang membentuk ikatan kovalen ditandai oleh garis penghubung (-).
 Air mengandung molekul H2O. Atom oksigen yang mempunyai 6 elektron valensi membutuhkan 2 elektron lagi agar seperti gas mulia. Kedua elektron itu diperoleh dari dua atom hidrogen. Jadi atom oksigen dapat membentuk dua ikatan kovalen dalam molekul H2O.
Air mengandung molekul H2O. Atom oksigen yang mempunyai 6 elektron valensi membutuhkan 2 elektron lagi agar seperti gas mulia. Kedua elektron itu diperoleh dari dua atom hidrogen. Jadi atom oksigen dapat membentuk dua ikatan kovalen dalam molekul H2O.
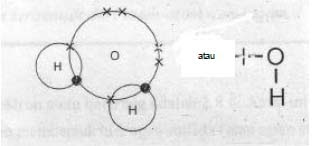 Gambar 3. Dua ikatan kovalen dalam molekul air.
Gambar 3. Dua ikatan kovalen dalam molekul air.
Pembentukan molekul metana, CH4 dapat kita ikuti pada gambar 4. Atom karbon dengan konfigurasi elektron 2. 4 memerlukan 4 elektron tambahan agar seperti gas mulia neon, sehingga karbon membentuk 4 ikatan kovalen.
 Gambar 4. Metana yang memiliki Empat Ikatan Kovalen
Gambar 4. Metana yang memiliki Empat Ikatan Kovalen
Beberapa atom dapat membentuk ikatan rangkap. Pada ikatan kovalen tunggal mengandung dua elektron, ikatan kovalen rangkap dua mengandung empat elektron, sedang dalam ikatan rangkap tiga terdapat enam elektron. Pada molekul karbon dioksida, CO2 terdapat dua buah ikatan rangkap dua. Ketiga atomnya sekarang masing-masing memiliki 8 elektron terluar. Sedang pada molekul nitrogen, N2 setiap atomnya menyumbangkan 3 elektron untuk digunakan bersama-sama sehingga setiap atom N memiliki elektron valensi 8.
 Gambar 5. Ikatan rangkap dua pada CO2 dan rangkap tiga pada N2
Gambar 5. Ikatan rangkap dua pada CO2 dan rangkap tiga pada N2
Warning :
- Atom-atom membentuk ikatan kovalen melalui penggunaan bersama pasangan elektron.
- Dalam ikatan kovalen setiap atom memiliki konfigurasi elektron seperti gas mulia.
- Ikatan kovalen terbentuk dari atom-atom non-logam.
Hampir semua senyawa kovalen terbentuk dari atom-atom non-logam. Dua atom nonlogam saling menyumbangkan elektron sehingga tersedia satu atau lebih pasangan elektron yang dijadikan milik bersama. Senyawa yang berikatan kovalen juga disebut senyawa kovalen.
Atom hidrogen memiliki sebuah elektron pada kulit pertamanya, agar konfigurasi elektronnya penuh seperti gas mulia helium maka hidrogen memerlukan satu elektron lagi (gambar 1). Gas hidrogen yang merupakan molekul H2 terdiri dari dua atom hidrogen yang saling menyumbangkan elektronnya sehingga masing-masing atom hidrogen memiliki konfigurasi elektron yang stabil.
Jika kita perhatikan gambar 1, elektron pada atom pertama diberi tanda titik kecil dan atom lainnya dengan titik besar. Pasangan elektron yang membentuk ikatan kovalen ditandai oleh garis penghubung (-).
 Air mengandung molekul H2O. Atom oksigen yang mempunyai 6 elektron valensi membutuhkan 2 elektron lagi agar seperti gas mulia. Kedua elektron itu diperoleh dari dua atom hidrogen. Jadi atom oksigen dapat membentuk dua ikatan kovalen dalam molekul H2O.
Air mengandung molekul H2O. Atom oksigen yang mempunyai 6 elektron valensi membutuhkan 2 elektron lagi agar seperti gas mulia. Kedua elektron itu diperoleh dari dua atom hidrogen. Jadi atom oksigen dapat membentuk dua ikatan kovalen dalam molekul H2O. Gambar 3. Dua ikatan kovalen dalam molekul air.
Gambar 3. Dua ikatan kovalen dalam molekul air.Pembentukan molekul metana, CH4 dapat kita ikuti pada gambar 4. Atom karbon dengan konfigurasi elektron 2. 4 memerlukan 4 elektron tambahan agar seperti gas mulia neon, sehingga karbon membentuk 4 ikatan kovalen.
 Gambar 4. Metana yang memiliki Empat Ikatan Kovalen
Gambar 4. Metana yang memiliki Empat Ikatan KovalenBeberapa atom dapat membentuk ikatan rangkap. Pada ikatan kovalen tunggal mengandung dua elektron, ikatan kovalen rangkap dua mengandung empat elektron, sedang dalam ikatan rangkap tiga terdapat enam elektron. Pada molekul karbon dioksida, CO2 terdapat dua buah ikatan rangkap dua. Ketiga atomnya sekarang masing-masing memiliki 8 elektron terluar. Sedang pada molekul nitrogen, N2 setiap atomnya menyumbangkan 3 elektron untuk digunakan bersama-sama sehingga setiap atom N memiliki elektron valensi 8.
 Gambar 5. Ikatan rangkap dua pada CO2 dan rangkap tiga pada N2
Gambar 5. Ikatan rangkap dua pada CO2 dan rangkap tiga pada N2Warning :
- Atom-atom membentuk ikatan kovalen melalui penggunaan bersama pasangan elektron.
- Dalam ikatan kovalen setiap atom memiliki konfigurasi elektron seperti gas mulia.
- Ikatan kovalen terbentuk dari atom-atom non-logam.




nak tanya...
BalasHapusapakah faktor yang membolehkan elektron terbebas daripada ikatan kovalen?????????? :-/